Rychlejší rozhodování, předvídatelnost a také větší kvalita ve smyslu souladu s odbornými doporučeními – to jsou změny, které si Všeobecná zdravotní pojišťovna slibuje od nové metodiky k paragrafu 16. Ta by měla začít platit 1. prosince a přinese s sebou zapojení odborných společností do rozhodování o tom, kterým pacientům může prospět standardně nehrazená léčba. Metodika má pomoci překlenout období, než bude problematika paragrafu 16 systémově upravena zákonem.
„Materiál by měl významným způsobem pomoci zjednodušit přístup klientů VZP k léčivým přípravkům, které byly schvalovány správním řízením podle paragrafu 16. V žádném případě nechceme vytvářet paralelní strukturu k existující struktuře SÚKL a nechceme ani nahrazovat rozhodování podle paragrafu 16. Pouze chceme vytvořit nástroj, který povede k tomu, aby rozhodování bylo rychlejší, předvídatelnější, jednodušší a aby bylo opřeno o odborné autority medicíny,“ přibližuje ředitel VZP Zdeněk Kabátek. „Chceme odstranit variabilitu v rozhodování revizních lékařů i v přístupu našich pojištěnců k péči a otevřeně formulovat situace, kdy pojištěnec z léčby profituje, a to na základě medicíny a spolupráce s odbornými společnostmi,“ dodává náměstek VZP David Šmehlík.
Odborné společnosti, nebo přinejmenším Česká onkologická společnost, krok hodnotí velmi kladně. „Nesmírně vítám vstřícné stanovisko plátců péče. Naším obrovským problémem je, aby pacienti byli léčeni podle mezinárodních standardů. Chceme, aby se naši pacienti k té správné léčbě ušité na míru dostali co nejdříve. Obecné stanovisko skupiny odborníků pro určitý léčivý přípravek, které se dostane do rukou reviznímu lékaři, bude dobrým předpokladem pro správné rozhodnutí. Naprosto chápu, že revizní lékař, který není odborníkem příslušného oboru, nemůže zcela jednoznačně pro jednotlivého pacienta rozhodnout, pokud nemá v ruce správný návod,“ kvituje snahu předsedkyně onkologické společnosti Jana Prausová.
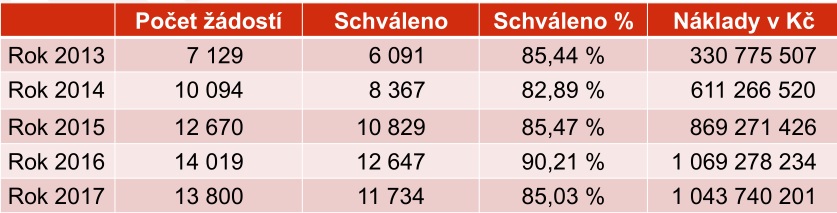
Potřeba řešit paragraf 16 vznikla z toho, že se počet žádostí od roku 2013 zdvojnásobil a náklady na léčiva takto uhrazená vzrostly dokonce třikrát. Nově předkládaná metodika ošetřující postup u léčiv s dosud nestanovenou úhradou nebo v případech, které jsou mimo stanovené podmínky, by přitom měla proces při posuzování tisíců žádostí více standardizovat. Zároveň se nepočítá s tím, že by novinka systém rozvolnila nebo utáhla, takže se nepředpokládá zásadní nárůst nákladů.
Nový postup se ale uplatní pouze v případech, kdy už držitel rozhodnutí o registraci daného léku požádal SÚKL o stanovení maximální ceny a podmínek úhrady. „Předpokládáme, že pro léčivé přípravky, kde držitel registrace je přítomen na území České republiky, dojdeme k dohodě, že součástí procesu bude, že o úhradu zažádá tak, aby přípravek byl standardně zhodnocen SÚKL, tedy aby byla zreferencována maximální cena. Pokud držitel není přítomen na území ČR, budeme postupovat jako předtím,“ vysvětluje náměstek Šmehlík s tím, že odborníci se budou vyjadřovat i k těmto případům.
Mohlo by vás zajímat
VZP bude mít nové dva poradní orgány
Jak by tedy nově měl přístup pojišťovny vypadat? Budou ustanoveny dva poradní orgány – pracovní skupina pro nehrazené léčivé přípravky a komise pro nehrazené léčivé přípravky, v jejichž rámci by měla probíhat odborná diskuse. Tyto orgány budou půl na půl složeny ze zástupců odborných společností a pracovníků VZP. Úkolem pak bude nalézt společné stanovisko, které definuje, za jakých podmínek má být daný léčivý přípravek hrazen – u jakých skupin pacientů, v jaké linii léčby či s jakými medicínskými ukazateli. Pokud bude očekávaný dopad do rozpočtu do 30 milionů, bude k danému léku stačit stanovisko pracovní skupiny, v případě, že bude očekávaná částka vyšší, se problematikou musí zabývat komise. Jednání přitom budou vyvolána na základě medicínské potřeby, a to jak ze strany VZP, tak odborné společnosti.
Složení komise či pracovní skupiny ale nebude konstantní. Vedle onkologie přes paragraf 16 plynou často žádosti také z hematoonkologie, revmatologie, kardiologie či vzácných onemocnění – a podle toho, o jakého onemocnění se bude jednání týkat, bude také navrženo složení účastníků. „Předpokládáme, že u některých řízení nemusí být přítomni pouze zástupci jedné odborné společnosti, ale více společností, a bude se to logicky měnit. Předpokládáme, že identifikujeme situaci, oslovíme příslušnou odbornou společnost a domluvíme se na počtu a složení členů tak, aby komise naplňovala parametry procesu,“ objasňuje Šmehlík.
Rozhodnutí pak budou přijímána prostou většinou, v případě shody bude mít rozhodující hlas předsedající. Tím je v pracovní skupině náměstek VZP, v komisi ředitel VZP. Stanoviska nad 30 milionů se tak uzavírají podpisem ředitele. Platnost bude 12 měsíců; v případě, že bude delší, musí být alespoň jednou ročně provedena revize. Stanovisko bude veřejné a zájemci ho najdou na webu VZP, případně odborné společnosti. Nová rozhodnutí také budou pravidelně předkládána na zasedáních pacientské rady VZP.
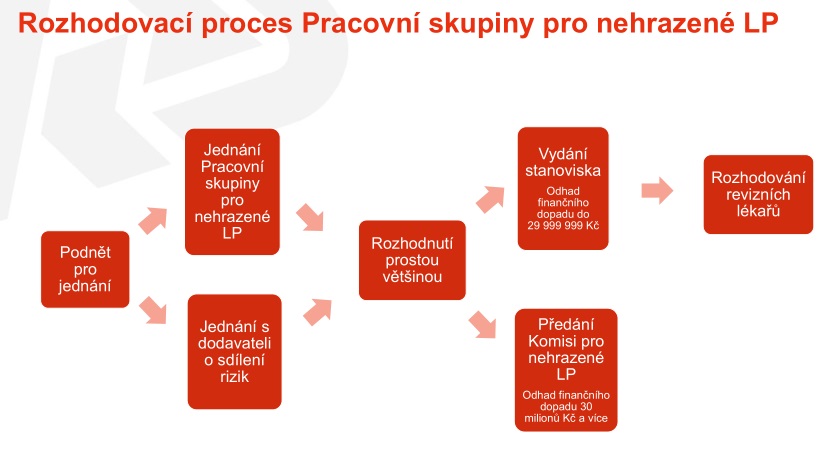
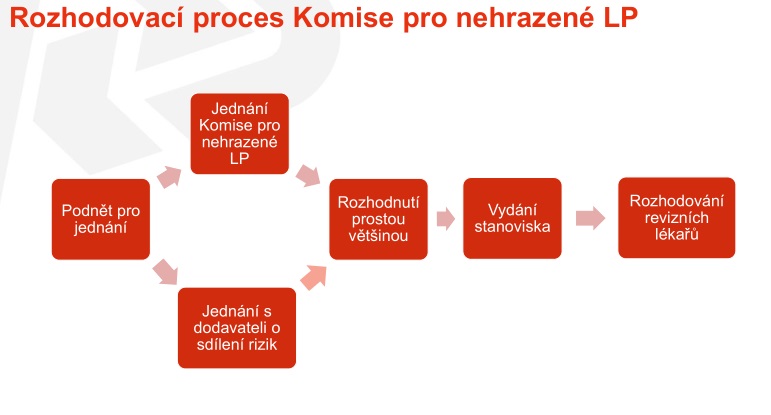
Stanovisko by mělo obsahovat identifikaci léčivého přípravku, podmínky úhrady nebo indikační omezení úhrady formulované na základě dohody s odborníky, dále kvalifikovaný odhad předpokládaného počtu pacientů, navrhovaný způsob realizace úhrady, předpokládaný celkový finanční dopad a vymezení nebo způsob vymezení okruhu dotčených poskytovatelů zdravotních služeb – tedy zda půjde o centra či specializovaná pracoviště a kdo by měl indikovat léčbu.
Rozhodnutí bude následně sloužit jako podklad pro rozhodování revizních lékařů i pro další činnost pojišťovny v rámci správních řízení. I nadále přitom zůstane finální rozhodnutí na revizním lékaři, bude se ale mít o co opřít. „Při konstrukci nástroje jsme částečně vycházeli i z námětů a požadavků revizních lékařů,“ doplňuje ředitel Kabátek, který předpokládá, že první závěry pracovní skupiny či komise by mohly být v horizontu měsíce.
Rychlý vstup inovativních léků je i prioritou ministerstva
Paralelně se zasedáním pracovní skupiny či komise probíhá jednání s držiteli rozhodnutí o registraci o ceně, za kterou léčivý přípravek na trh dodá. „Identifikovali jsme situace, kdy v indikacích, u nichž léčivému přípravku nebyla stanovena úhrada z veřejného zdravotního pojištění, docházelo k rozdílné výši úhrady než v situacích, kde bylo rozhodnutí vydané SÚKL. Tuto situaci bychom chtěli ošetřit,“ vysvětluje Šmehlík s tím, že v tomto ohledu by mohla pojišťovna nějaké prostředky ušetřit – dosud se totiž stávalo, že za přípravek schválený mimo vytyčené indikace zaplatila více, než kolik stanovil SÚKL.
Náměstek Šmehlík ovšem dodává, že uzavření smlouvy upravující cenu přípravku a počty léčených pacientů není nutnou podmínkou. Smlouva o sdílení rizik je přitom uzavírána do doby rozhodnutí SÚKL ve správním řízení, ovšem maximálně na tři roky. Sdílení rizik ze strany držitele rozhodnutí o registraci pak může mít podobu např. zpětné platby, snížení ceny léku mechanismem přímého ponížení jednotkových nákladů na balení či platby za výsledek. Poslední zmíněná možnost je přitom podle ředitele Kabátka pro pojišťovnu velmi zajímavá (ba dokonce ze zmíněných variant nejzajímavější), nicméně ze strany držitelů rozhodnutí o registraci nelze očekávat, že se vzápětí stane standardním nástrojem. „Intenzivně jsme ale nakročili k tomu, abychom těchto smluv získali větší počet, než tomu bylo v minulosti,“ doufá Kabátek.
Téma rychlého přístupu inovativních léčiv pro pacienty obecně je přitom také jednou z priorit ministerstva zdravotnictví. Proto na začátku tohoto roku vznikla na ministerstvu pracovní skupina pro revizi cen a úhrad léků, které se účastní všichni stakeholdeři a jež má přijít s návrhem, jak věc řešit.
„Chceme již na začátku příštího roku představit legislativní záměr v paragrafovém znění veřejnosti, poslat ho do připomínkového řízení a následného legislativního procesu. Legislativní proces ale může trvat dlouho, až jeden rok, a víme, že jeden rok je z pohledu pacienta čekajícího na svou léčbu poměrně dlouhá doba. Proto podporujeme SÚKL i pojišťovny, aby se pokoušely v rámci stávající legislativy upravit své interní schvalovací procesy tak, aby schvalování léčiv bylo co nejrychlejší a zaměřené na expertní posouzení a přínos daného léčivého přípravku pro pacienta. Budeme tedy sledovat úspěšnost procesu VZP, kterým se případně můžeme inspirovat při tvorbě legislativy během příštího roku,“ dodává náměstek ministra zdravotnictví Filip Vrubel.
Michaela Koubová