Biofarmaceutická společnost AbbVie oznámila, že její lék HUMIRA (adalimumab) byl schválen k léčbě středně těžkých a těžkých forem hidradenitis suppurativa (acne inversa) u dospělých, kteří nedostatečně reagují na konvenční systémovou léčbu. HUMIRA je nyní prvním a jediným lékem schváleným pro léčbu této nemoci v Evropské unii. Podrobnosti AbbVie zveřejnila ve své tiskové zprávě.
„Pacienti s hidradenitis suppurativa (HS) často trpí bolestivými a nepříjemnými příznaky, které mají negativní vliv na kvalitu jejich života,“ uvedla ve zprávě doc. MUDr. Monika Arenbergerová, Ph.D., z Dermatovenerologické kliniky Fakultní nemocnice Královské Vinohrady. „HUMIRA je prvním schváleným lékem s prokazatelným účinkem – zmírňuje příznaky HS včetně bolesti a tlumí aktivitu onemocnění, což představuje důležitý pokrok v léčbě HS.“
Uvedení na trh je podloženo výsledky dvou 36týdenních klíčových klinických studií fáze III, nazvaných PIONEER I a PIONEER II a rozdělených do dvou částí, kterých se zúčastnilo 633 pacientů se středně těžkými a těžkými formami HS. Pacienti byli v těchto studiích randomizováni tak, aby kromě lokálních antiseptik obdrželi buď lék HUMIRA, nebo placebo. Obě studie prokázaly ve skupině pacientů, jimž byl podáván přípravek HUMIRA, výraznější pokles počtu abscesů a zánětlivých nodulů než ve skupině pacientů, kteří dostávali placebo. Během těchto klinických studií nebyla zaznamenána žádná nová bezpečnostní rizika. Navíc ve studii PIONEER II vykázal ve 12. týdnu signifikantně vyšší počet pacientů, jimž by podáván lék HUMIRA, klinicky významný pokles bolestivých stavů souvisejících s HS, než tomu bylo ve skupině pacientů, kterým bylo podáváno placebo. Další informace o klinických studiích PIONEER I a PIONEER II jsou dostupné na stránkách www.clinicaltrials.gov (klinické studie NCT01468207 a NCT01468233).
Mohlo by vás zajímat
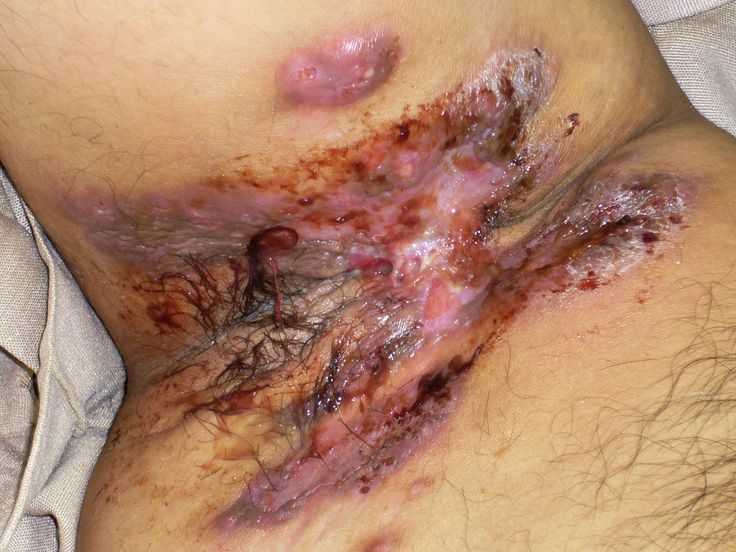
Co je hidradenitis suppurativa (acne inversa)
Hidradenitis suppurativa, dermatology někdy označovaná také jako acne inversa, je bolestivé, chronické zánětlivé kožní onemocnění. Odhaduje se, že HS postihuje přibližně 1 % celkové dospělé populace. Je charakterizována recidivujícími zánětlivými abscesy a noduly na kůži, typicky v oblasti podpažních jamek a třísel, na hýždích a pod prsy. HS může mít výrazný dopad na běžné denní činnosti pacientů, jejich pracovní schopnosti, fyzické aktivity a emoční stav.
HS může mít u některých pacientů rychlý průběh. U pokročilých stádií může připadat v úvahu i chirurgické odstranění postižených oblastí kůže. Proto je důležité včasné stanovení diagnózy a brzké zahájení léčby. To však může být obtížné a u mnoha pacientů s HS bývá diagnóza a tím pádem i léčba opožděná. Pro pacienty trpící HS i ty, kteří na ni mají podezření, je proto klíčové, aby navštívili zkušeného dermatologa schopného tuto chorobu rozeznat a léčit.
Terapeutická indikace léku HUMIRA v zemích Evropské unie11
Od prvního uvedení na trh před 12 lety byl lék HUMIRA schválen k užívání v již více než 87 zemích. Tento přípravek je v současnosti celosvětově schválen ve 13 indikacích a je jím léčeno více než 850 000 pacientů po celém světě. Lék HUMIRA je schválen k léčbě středně těžké až těžké revmatoidní artritidy, těžké aktivní ankylozující spondylitidy (AS), těžké axiální spondylartritidy bez radiologického průkazu AS, středně těžké až těžké chronické ložiskové psoriázy, aktivní a progresivní psoriatické artritidy, středně těžké až těžké aktivní Crohnovy choroby, středně těžké až těžké aktivní ulcerózní kolitidy a aktivní středně těžké až těžké formy hidradenitis suppurativa. Přípravek HUMIRA je schválen k léčbě dětských pacientů s entezopatickou artritidou, těžkou chronickou ložiskovou psoriázou, těžkou aktivní Crohnovou chorobou a aktivní polyartikulární juvenilní idiopatickou artritidou, kteří nedostatečně odpovídali na předchozí terapii. Úplné informace o indikaci naleznete v souhrnu údajů o přípravku.
Informace o bezpečnosti přípravku pro země Evropské unie
Lék HUMIRA nesmí být podáván pacientům s aktivní tuberkulózou nebo jinými závažnými infekcemi a pacientům se středně těžkým až těžkým srdečním selháním. Užívání přípravku HUMIRA zvyšuje pravděpodobnost rozvoje závažných infekcí, které mohou být v ojedinělých případech život ohrožující. Ve skupině pacientů léčených antagonisty tumor nekrotizujícího faktoru (TNF) byly vzácně hlášeny případy lymfomů a leukémie. Ojediněle se vyskytly případy hepatosplenického T-buněčného lymfomu, vzácného závažného typu nádorového onemocnění často končícího úmrtím. U pacientů léčených antagonisty TNF nelze vyloučit riziko vzniku malignit. Nejčastěji hlášené nežádoucí účinky v případě všech indikací zahrnovaly infekce horních cest dýchacích, reakce v místě vpichu, bolesti hlavy, bolesti břicha, nauseu, vyrážku a muskuloskeletální bolesti.
O společnosti AbbVie
AbbVie je mezinárodní biofarmaceutická společnost zaměřená na výzkum a vývoj nových léků. Vznikla v lednu 2013 oddělením od společnosti Abbott. Společně se svou dceřinou společností Pharmacyclics zaměstnává celosvětově okolo 28 000 lidí a prodává své léky ve více než 170 zemích světa.
-tz, red-