Mají mít léky s potenciálem závislosti povolení pro použití u nemocných dětí, anebo ne? To je otázka, kterou se v současnosti zabývají američtí odborníci. Zatímco jedna část odborné veřejnosti zastává názor, že by lék, který se beztak v současnosti předepisuje off-label, tedy mimo schválené indikace, měl mít jasně dané doporučené dávkování, druhá část je znepokojena způsobem, jakým ke schválení použití u dětí došlo. Obává se také, že přípravek nebudou užívat jen vážně nemocné děti, ale i ty s krátkodobými bolestmi.
Jsou to dva měsíce, co americká léková agentura (FDA) schválila pro určité diagnózy u dětí narkotikum tlumící bolest OxyContin (účinná látka oxykodon). Od té doby toto rozhodnutí vyvolává rostoucí vlnu nevole mezi zákonodárci a veřejnými činiteli, kteří zápasí se zdrcujícími čísly vypovídajícími o zneužívání předepisování opioidů. Minulý týden dokonce přednesla Hillary Clintonová téma v rámci prezidentského předvolebního boje. Podle ní je rozhodnutí agentury naprosto nepřijatelné.
Podstatou problému je otázka, zda povolení povede ke zvýšenému předepisování OxyContinu u mladých pacientů. Už léta je tento silný a dlouho působící lék předepisován off-label velmi nemocným dětem s bolestmi způsobenými rakovinou nebo po spinální fúzi. Podle komisaře FDA Stephena Ostroffa nyní lékaři díky rozhodnutí agentury získají informace o tom, jak a kdy je použití těchto léků skutečně na místě, což zahrnuje i doporučení ohledně dávkování.
Mohlo by vás zajímat
„Je nám jasné, že jde o velmi citlivé téma. Je třeba rozhodnutí rozumět v kontextu, v jakém bylo učiněno,“ reagoval podle The New York Times Ostroff na dotaz, co říká na reakci Hillary Clintonové.
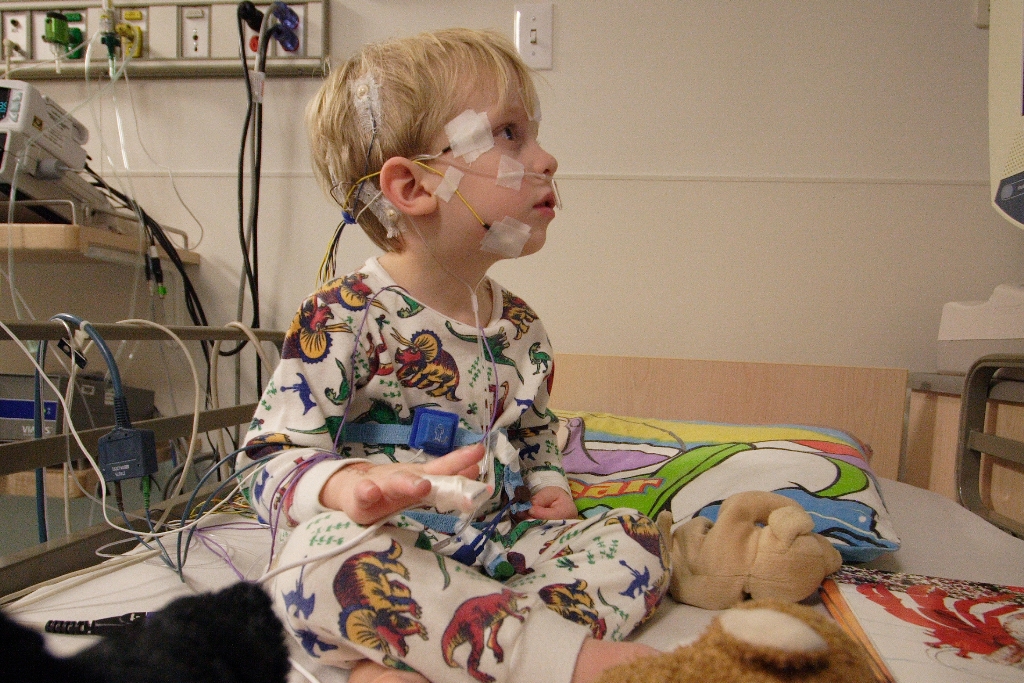
Dětská onkoložka Kathleen Nevillová z arkansaské dětské nemocnice běžně léčí děti s nepolevujícími bolestmi způsobenými rakovinou nebo se srpkovou anémií. Právě její pacienti jsou přitom ti, kteří by podle FDA měli mít z OxyContinu přínos, a to navzdory riziku závislosti a zneužívání – na což ostatně nyní upozorňuje příbalový leták. Nevillová, která říká, že nemá žádné finanční vazby na výrobce léku, rozhodnutí lékové agentury chválí. „Jen proto, že byl OxyContin byl zneužíván nebo předepisován nevhodně, ho ještě nemusíme odepírat dětem, které ho skutečně potřebují. Je naše povinnost mít co nejvíce důkazů pro použití u dětí,“ říká Nevillová. S lidmi, kteří striktně odmítají podávání OxyContinu u dětí, si nebere servítky. „Zkuste si být jedním z mých dětských pacientů, kteří mají pánev rozežranou od rakoviny,“ vzkazuje na jejich adresu.
Změní se schéma užívání, bojí se oponenti
Nová doporučení uvádějí, že OxyContin je možné použít jen u dětí ve věku 11 let a více, a to v případě závažných bolestí a pokud užívaly opioidy minimálně pět dní. Lék tedy není možné předepsat jako opioid tlumící bolest v první linii léčby. Není taká určen pro krátkodobé bolesti, tedy např. u teenagerů po vytržení zubů moudrosti.[infobox]
]Někteří znalci trhu s léčivy si ovšem nemyslí, že Purdue Pharma, výrobce OxyContinu, sdílí názor FDA. „Výrobci se neřídí schválením regulátora, aby poskytli předepisujícím lékařům a pacientům přidané informace. Schválení umožňuje Purdue Pharmě obchodovat a podporovat přípravek pro použití u dětí. Zjevné znepokojení pak panuje ohledně toho, že se změní schéma užívání,“ obává se doktor G. Caleb Alexander, ředitel Centra pro lékovou bezpečnost a účinnost při Johns Hopkins Bloomberg School of Public Health.
Na protest Hilary Clintonové zareagoval už i samotný výrobce. „Sdílíme znepokojení ministryně Clintonové ohledně nadužívání a zneužívání opioidů, což je také důvod, proč Purdue nebude podávat pediatrům a dalším lékařům nové informace o bezpečnosti a dávkování OxyContinu u dětí,“ uvedl v tiskovém prohlášení mluvčí společnosti Robert Josephson. Farmafirma už přitom byla jednou shledána vinnou kvůli informacím ohledně OxyContinu. V roce 2007 ji federální soud odsoudil za klamání lékařů, pacientů i regulátorů ohledně potenciálu, který má lék v souvislosti se zneužíváním.
Schvalování bez poradní komise
Některé kritiky pak pramení ze způsobu, jakým FDA rozhodnutí udělala. Agentura běžně svolává nezávislou poradní komisi, která vyslyší experty zvenčí ohledně věcí, které jsou ve veřejném zájmu nebo mohou být kontroverzní. V roce 2012 komise projednávala jiný dlouhodobě působící opioid proti bolesti Zohydro ER (obsahuje hydrokodon), a v poměru 11 ku dvěma hlasovala proti schválení. Přesto ovšem agentura lék schválila. Pro posouzení OxyContinu a jeho užití v pediatrii už žádná komise svolána nebyla. „Jsem si téměř jist, že by komise hlasovala proti,“ podotýká Andrew Kolodny, výkonný ředitel Lékařů pro zodpovědné předepisování opioidů. „Je těžké si představit nějakou vědeckou poradní platformu, která by v současném prostředí OxyContin pro tyto účely doporučila ke schválení,“ myslí si doktor Alexander, který je členem jiné poradní komise FDA.
Léková agentura si ovšem trvá na svém. „Udělali jsme dobrou věc. Bylo skandální, že americké děti dostávaly léky bez řádných informací ohledně dávkování a bezpečnosti,“ domnívá se Janet Woodcocková, ředitelka Centra pro hodnocení léků a výzkum při FDA.
Vděčni za tento přístup jsou rodiče nemocných dětí. To platí i o Vickie Buengerové, jejíž dcera zemřela v roce 2009 v 11 letech na rakovinu. Ten samý rok před svou smrtí však ještě vyslovila přání, že by ráda chodila do školy. Díky OxyContinu, který utlumil její jinak neustávající bolesti, se její přání splnilo. „Když neměla léky, nedokázala ani zvednout hlavu,“ říká Vickie Buengerové, která je ráda, že FDA uvedlo správné dávkování léku, takže se jiné rodiny nebudou muset spolehnout jen na odhad lékaře.
Léková agentura žádá další studie
FDA chce ovšem po Purdue Pharmě, aby předložila další studie. Jedna by měla sledovat po dobu tří let nežádoucí účinky, jako je dechová nedostatečnost, předávkování či náhodné užití u dětí ve věku 11 až 17 let. Léková agentura pak požaduje obsáhlou analýzu těchto nežádoucích účinků či medicínských pochybení. Společnost pak také bude muset předložit celonárodně reprezentativní data ohledně množství předpisů dětem do 17 let, dále kteří lékaři přípravek předepisují a pro jaké diagnózy.
„Měli bychom mít jistotu, že se lék u dětských pacientů užívá dle daných indikací. To by nám ve výsledku mohlo poskytnout mnohem lepší informace o tom, jak se lék u dětí užívá, oproti tomu, co bychom věděli při dosavadní praxi předepisování off-label,“ dodává doktor Ostroff, podle něhož budou některá data zveřejněna.
-mk-