Česká republika má rezervy v tom, jak přilákat co nejvíce farmafirem, aby u nás prováděly klinické studie. Z těch přitom profituje jak systém na úsporách za léčbu, tak pacient, který se dostává k nejmodernější možné terapii. Jen v loňském roce tak farmaceutické firmy v Česku investovaly 1,75 miliardy a v rámci skoro čtyř stovek studií poskytly léčiva za celkem 625 milionů korun. Kvůli zvětšující se konkurenci a dlouhým lhůtám do uzavření smluv to ale může být brzy méně.
„Dramaticky rostou náklady spojené s klinickými hodnoceními. Jak schvalovací orgán ve Spojených státech, tak Evropská léková agentura kladou stále větší důraz na bezpečnost, množství i délku hodnocení, které provádíme. Jako vysoce efektivní se proto ukazuje spolupráce v rámci malých hubů v Evropě a USA. Stále více se outsourcuje do fakultních nemocnic. Sledujeme, že farmaprůmyslem už nehýbe tolik trend obrovských výzkumných center, naopak dochází k diverzifikaci a snaze najít co nejvíce partnerů, kteří pomůžou jak v oblasti základního výzkumu, tak v klinických studiích,“ přibližuje výkonný ředitel Asociace inovativního farmaceutického průmyslu Jakub Dvořáček. Podle něj vývoj jednoho léku, u něhož byl proces úspěšně dotažen do konce, stojí miliardu dolarů, pokud ale zohledníme množství preparátů, které po cestě skončí, vyškrabe se cena na čtyři až pět miliard.
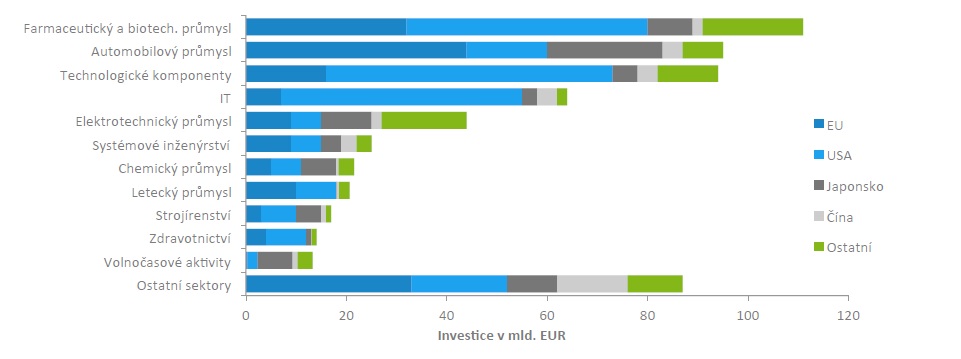
Farmaceutický průmysl je přesto odvětví, které stále roste. Do roku 2020 se očekává růst globálního trhu o čtyři až sedm procent, přičemž celková hodnota farmaceutického trhu v loňském roce činila 1,1 bilionu amerických dolarů. Zároveň je farmaprůmysl lídrem v objemu investic do vědy a výzkumu – v USA činí 15 a v Evropě 13 procent. Z celkových tržeb je pak 40 procent generováno ve Spojených státech, nejvíce aktivit se vedle USA odehrává také v Evropě. Výrazně ovšem začínají růst Rusko, Brazílie či některé regiony v Asii. Právě v Asii také v letech 2006 až 2012 vzrostla zaměstnanost v sektoru o 5,7 procenta.
„S touto konkurencí budeme muset do budoucna počítat. Abychom byli atraktivní i nadále, budeme muset prostředí nadále kultivovat a zlepšovat. Dramaticky navíc roste konkurence mezi státy, což můžeme sledovat i na našem regionu,“ zdůrazňuje Jakub Dvořáček.
Domluva na smlouvě s nemocnicí často trvá přes půl roku
Česká republika má firmám co nabídnout, bohužel jsou tu ale stále bariéry, které mohou investory odradit. Pozitivní je přístup lékařů k přípravě zázemí, patentová ochrana, nábor pacientů či stále ještě finanční atraktivita. Roli hraje také pozitivní mediální obraz klinických studií. AIFP chválí i způsob fungování SÚKL, který je podle asociace srovnatelný se špičkovými institucemi ve světě, mimo jiné v dodržovaných lhůtách.
„Základní indikátor, který ovlivňuje, zda klinická studie půjde do naší země či ne, je počet pacientů, tedy kolik jich můžeme pro daný projekt nabídnout, a pak je tu otázka časová – za jak dlouhou dobu jsme schopni projekt zrealizovat. S velikostí naší země a počty pacientů nic neuděláme, body navíc ale můžeme získat rychlostí realizace daného projektu. Pokud ve studiích proveditelnosti něco slíbíme, třeba že za deset měsíců zajistíme deset pacientů, tak to v naprosté většině případů dodržíme. Kde pokulháváme, je schvalovací začátek nových studií,“ říká Beata Čečetková, která má v AIFP na starosti pracovní skupinu pro klinické hodnocení.
Mohlo by vás zajímat
Zatímco cesta přes SÚKL a etickou komisi je v podstatě bezproblémová, komplikace nastávají při domluvě na realizaci v daném zdravotnickém zařízení. Nejdéle trvá uzavření smlouvy o klinické studii v přímo řízených organizacích, na druhém místě jsou nemocnice regionální. Soukromá a ambulantní zařízení v tomto problém nemají, jenže většinou nesplňují požadavky na rané fáze výzkumu.
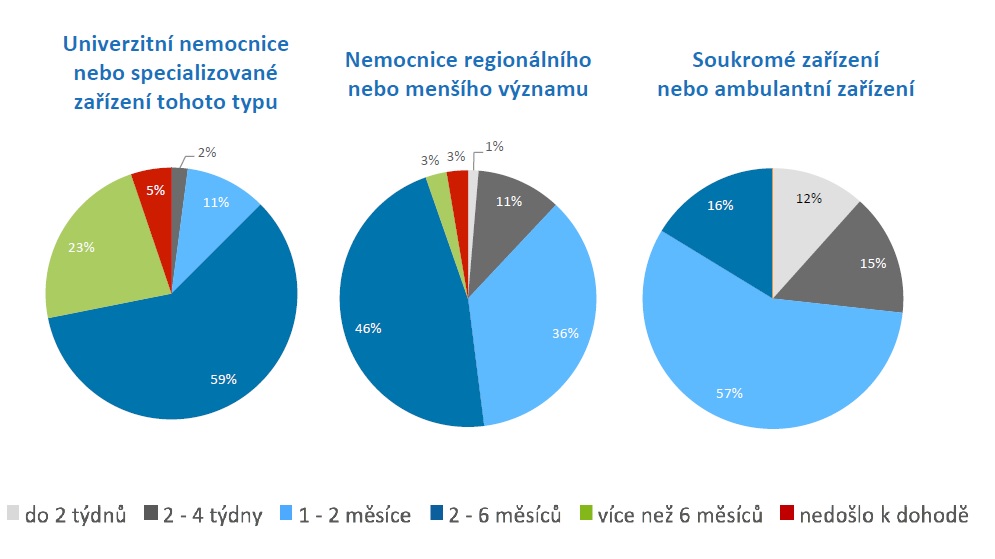
„Trápí nás poměrně vysoký počet studií, které se projednávaly více než šest měsíců. Je zde i nezanedbatelné procento projektů, které se nedodělaly. Tady bychom viděli společný postup s managementy zdravotnických zařízení, abychom našli postup, jak čas zkrátit,“ dodává Beata Čečetková. Podle Jakuba Dvořáčka by také bylo na místě domluvit se s fakultními nemocnicemi na používání stejného právního přístupu. „Neřešili bychom pak každou nemocnici zvlášť a nemuseli se o tom dohadovat znova a znova. Měli bychom být schopni říct, co jsme schopni unifikovat a kde můžeme postupovat společně. My třeba v Česku musíme uzavřít smlouvu zvlášť s nemocnicí, lékárnou, laboratoří a tak dále. V ekonomikách typu Německo či Francie je to jedna daná věc. U nás to pak narůstá a prodražuje se,“ dodává Dvořáček.
Problém potvrzuje také docentka Regina Demlová, primářka oddělení klinických hodnocení na Masarykově onkologickém ústavu. „Smluvní vztahy pro zahájení studie jsou v Česku problém a jsme trochu pozadu, protože nám to trvá déle. Ideální čas pro iniciaci klinické studie je dva až tři měsíce,“ uvádí docentka Demlová.
Univerzitní výzkum potřebuje koordinaci
Konkurence ostatním státům ovšem není jedinou cestou, kterou se může výzkum ubírat. Další je spolupráce, díky níž je možné sdílet vědecké poznatky, postupy a náklady. Přes výhody, které tato cesta nabízí, je ale zatím třicet procent komerčních a jen tři procenta akademických studií nadnárodních. Právě na studie iniciované z půdy akademické se v nadnárodním měřítku zaměřuje evropská nezisková organizace ECRIN, která v současnosti sdružuje sedm evropských států a dva pozorovatele, k nimž v tuto chvíli patří i Česko.
„Když chcete nadnárodní studii, potřebujete pacienty, potřebujete znát regulace a potřebujete činnosti zkoordinovat tak, aby stejná studie mohla běžet v Česku, Německu, Anglii a podobně,“ vysvětlil na mezinárodní konferenci věnované klinickým studiím, která se konala minulý týden na půdě senátu, ředitel ECRIN Jacques Demotes. Společnost nyní poskytuje poradenské a manažerské služby v rámci více než třiceti studií, které probíhají minimálně ve dvou členských státech. Průměrně tak v každé zemi včetně pozorovatelů běží sedm studií podporovaných ECRIN.
Podobná struktura je ovšem pochopitelně potřeba také na národní úrovni, aby se spolu domluvily jednotlivé fakultní nemocnice a ústavy, které studie provádějí. V ČR má toto na starost CZECRIN (financovaný zatím z MŠMT), díky němuž je možné iniciovat akademické klinické studie. „Tyto studie jsou nezávislé a například mohou srovnávat dvě tři léčiva od různých firem, ale samozřejmě přijít i s novými nápady z akademické půdy. Aby se to ale dostalo k pacientovi, je třeba organizovat klinickou studii, což je velmi znalostně i koordinačně náročné,“ přibližuje docentka Demlová. V současnosti je do CZECRIN zapojeno šest velkých fakultních nemocnic (Motol, Olomouc, obě brněnské nemocnice, Ostrava a Hradec Králové).
Význam akademických studií podtrhává profesor Jaroslav Štěrba, šéf kliniky dětské onkologie při FN Brno. „Situace v dětské onkologii obecně je poměrně problematická z toho důvodu, že děti jsou dlouhodobě na okraji zájmu farmaceutických společností. Firmy nejsou motivovány, aby zkoušely něco na dětech, protože těch se zhoubným nádorem je málo a je to malý trh, takže se to ekonomicky nevyplatí. Jsme tedy odkázáni na vlastní akademický výzkum, na který nemáme administrativní aparát ani potřebné regulační znalosti. Naše pracoviště je proto jedno z koordinačních center CZECRIN a studie může realizovat. Na lékařské fakultě Masarykovy univerzity například vyrábíme unikátní protinádorovou vakcínu z bílých krvinek pacienta. To by bez CZECRIN a ECRIN nebylo možné,“ vysvětluje profesor Štěrba. Podobně znevýhodněni jsou i pacienti se vzácnými chorobami a také geriatričtí pacienti, s nimiž je obtížnější spolupráce.
Počet žádostí o klinické studie na SÚKL ubývá
Pro konkurenceschopnost evropských států vůči zbytku světa je také nyní nutné dokončit implementaci evropské směrnice týkající se klinických studií. Novela zákona o léčivech, která s tímto přichází (mluví se o ní hlavně kvůli problematice reexportů, již řeší), teď leží v poslanecké sněmovně.
„Evropa začíná tahat za kratší konec, na což reagovala tím, že vydala směrnici ke klinickým hodnocením, kterou nyní transponujeme. EU si od implementace slibuje, že se zjednoduší, respektive zrychlí přístup klinických hodnocení. Zavádí se nový systém, kdy jeden ze států bude státem referujícím, takže třeba náš SÚKL bude referovat pro celou EU. Pravidla se tedy upravují tak, abychom byli více konkurenceschopní,“ vysvětluje náměstek ministra zdravotnictví a také jeden ze zakladatelů klinické jednotky v Thomayerově nemocnici Tom Philipp.
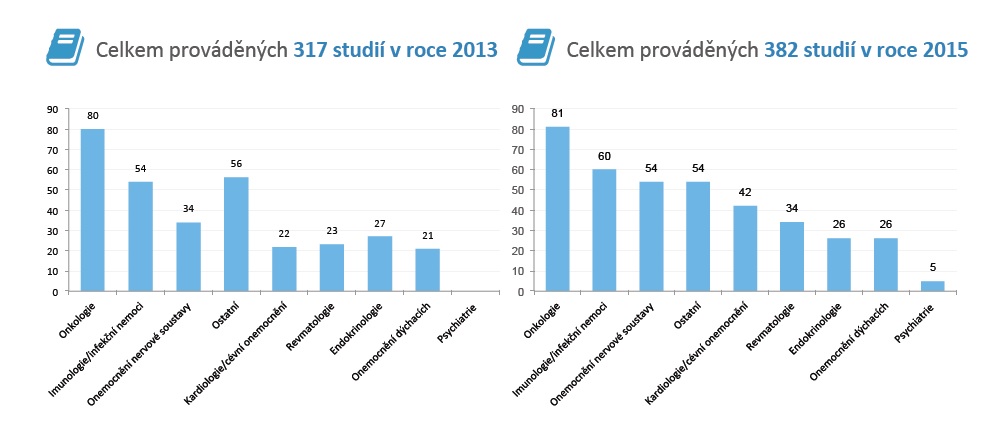
Jak jsme na tom tedy aktuálně v České republice? Zatímco v roce 2013 u nás běželo 317 klinických studií, loni jich bylo 382 (data pocházejí od 18 z 27 farmafirem sdružených v AIFP, které provádějí klinické studie, nezahrnují tedy celý farmaprůmysl a akademickou sféru). Nárůst přitom zaznamenaly nejvíce obory, jako je revmatologie a neurologie, nejčastěji byly studie ve třetí fázi.
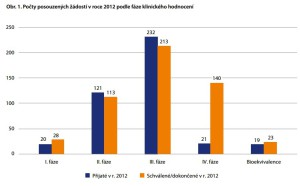
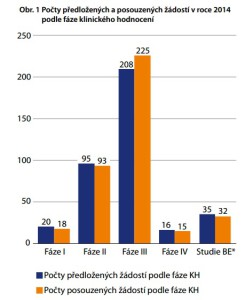
„Zaznamenali jsme ovšem také poměrně negativní signály týkající se klesajícího počtu žádostí o klinické studie v České republice. Je pro nás stále těžší a těžší obhájit přítomnost České republiky v zajímavých projektech,“ konstatuje Čečetková. Podle ní by pomohlo, kdyby v Česku fungovalo více center schopných zajistit technické a personální vybavení, které mohou provádět i náročnější studie v raných fázích výzkumu. Jedno z nich funguje například v Thomayerově nemocnici.
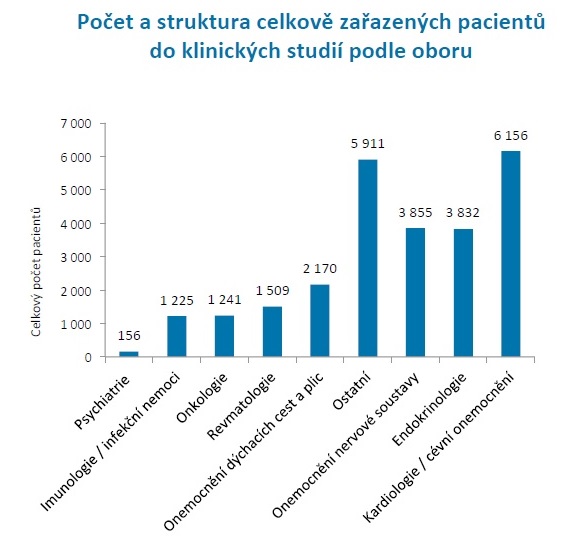
Dalším trendem je, že klesá množství pacientů zařazených do studií. Celkově bylo loni do studií zapojeno přes 26 tisíc pacientů, nově zařazených však od roku 2013 ubylo z necelých devíti tisíc na zhruba 6800. Největší pokles zaznamenala onkologie, kde z 4500 zapojených v roce 2011 ubylo na cca 1200 v loňském roce. Počet celkově zapojených týmů ovšem roste – z 1800 v roce 2013 na 2300 loni. Nejvíce se jich zaměřuje na kardiologii, onkologii a neurologii.
„Dnes už nepřicházejí přípravky, které by umožňovaly velké nábory pacientů. Jsou pryč doby, kdy byla indikační kritéria velmi široká. Čtvrtina přípravků, které přicházejí, jsou vázány na určitý biomarker. Tím se výrazně zužuje množství pacientů, kteří z nich mohou benefitovat. Na druhou stranu je tu výrazně větší šance, že pacient odpoví a léčba bude probíhat úspěšně,“ zdůvodňuje Jakub Dvořáček. Americká FDA například dosud schválila celkem 138 cílených léků a v roce 2014 tvořily tyto přípravky pětinu všech odsouhlasených léčiv.
Nejvíc ze studií profitují pacienti
Podtrženo, sečteno, loni farmaceutické společnosti v Česku investovaly 1,75 miliardy (v roce 2013 to bylo 1,9 miliardy) a k tomu uspořily až 625 milionů zdravotním pojišťovnám v nákladech na léky. Velká fakultní nemocnice tak díky tomu na medikaci ušetřila průměrně 67 milionů, což je dvojnásobek oproti roku 2013. Jen do rozpočtu SÚKL přitom na poplatcích poslaly farmafirmy sto milionů.
„Jde o investice s extrémně vysokou přidanou hodnotou. Směřují na nemocnice, lékaře a je tam obrovský benefit pro pacienta. Dnes jde o 26 tisíc pacientů v různých fázích klinického hodnocení, a to jsou lidé, kteří jsou léčeni tím nejmodernějším, co je v České republice v současné době k dispozici. Dává jim to naději na kvalitnější život i na přežití. I když je pacient léčen komparátorem, je mnohem více sledován a monitorován, takže má naprosto špičkovou péči,“ dodává Dvořáček s tím, že velkým přínosem je také v České republice nepříliš fungující transfer technologií.
Michaela Koubová