Díky biosimilars se dnes k nákladné biologické léčbě dostane mnohem více pacientů. Na rozdíl od generických léků (více jsme psali zde) ale v Česku zatím neumíme využít potenciál biosimilárních přípravků naplno – naopak, v poslední době se jejich vstup na náš trh zpomalil. Důvodem je zejména legislativní úprava, která snížila maximální ceny biosimilars o 30 procent. Vedle toho máme rezervy i v jednotlivých odbornostech: zatímco některé se používání biosimilars nebojí, jiné jsou k nim výrazně skeptičtější. Podle odborníků by proto byla na místě platforma, která by v této oblasti vydávala konsenzuální doporučení ohledně užívání biosimilárních léčiv. Problematikou se zabývali odborníci na kulatém stole Zdravotnického deníku s názvem Jak posílit roli generik a biosimilars ve zvyšování dostupnosti zdravotní péče a nákladové efektivity, který se konal na konci června v Praze.
„V oblasti biosimilars dochází k výraznému nárůstu počtu léčených pacientů, aniž by se zvyšovala zátěž systému veřejného zdravotního pojištění. Například v pomocné léčbě v onkologii se díky tomu stala biologická léčba vesměs rutinní záležitostí,“ říká Martin Mátl, výkonný ředitel České asociace farmaceutických firem.
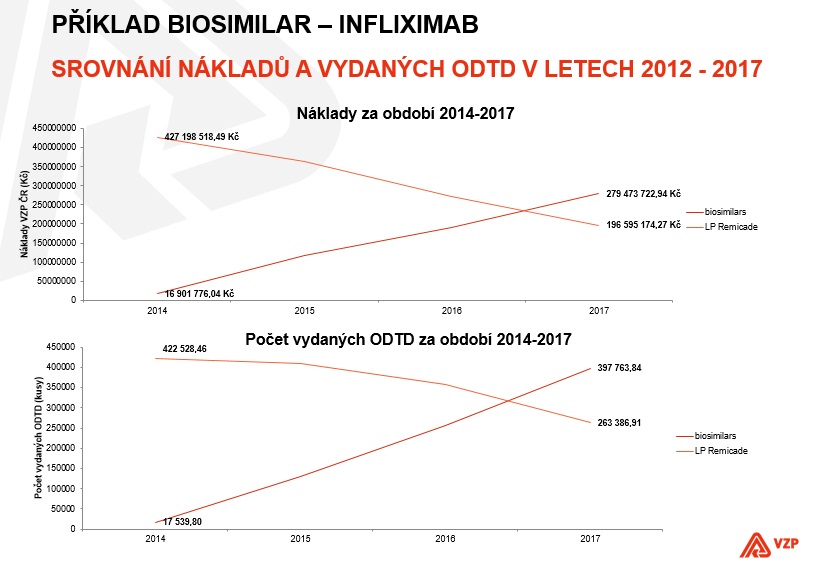
Potenciál úspor je přitom veliký – například za infliximab zaplatila VZP v roce 2017 476 milionů, což je sice o třicet milionů víc oproti roku 2014, ale za tu cenu dostala 660 tisíc denních dávek, tedy o 200 tisíc více než tři roky zpátky. „Pak je možné uvažovat o posunu terapie do dřívějších fází onemocnění, za což z medicínského hlediska bojujeme,“ poukazuje ředitelka Odboru léčiv a zdravotnických prostředků Všeobecné zdravotní pojišťovny Alena Miková. Její slova potvrzuje náměstek ministra zdravotnictví Filip Vrubel s tím, že i ministerstvo bude o takovéto rozšiřování usilovat.
Faktem na druhou stranu je, že v oblasti biosimilárních přípravků ještě máme rezervy a zůstává prostor pro jejich větší využití. „Co mě a naše členy trápí, je předvídatelnost a udržitelnost systému. Čas od času se stane, že se i v poslanecké sněmovně přijímají rychlá a nedodělaná řešení bez toho, aby bylo důsledně domyšleno, jaké budou mít dopady. To pak přispívá rozkolísanosti a možnému znehodnocování systému,“ uvádí Martin Mátl.
Řeč je zejména o pozměňovacím návrhu Rostislava Vyzuly (ANO), který loni navýšil procentuální sazby snížení maximálních cen u biosmilars z 15 na 30 procent (psali jsme např. zde). „Varoval jsem tehdy pana poslance, že to povede k odložení vstupu biosimilars. Je totiž hloupost srážet maximální viditelnou referencovatelnou cenu, protože v tu chvíli výrobci zařadí Českou republiku o několik měsíců dál. Zboří jim ceny v zemích, kde je Česká republika referencována,“ vysvětluje dopad novely ředitel Value Outcomes s.r.o. Tomáš Doležal.
Mohlo by vás zajímat

Že skutečně došlo ke zpoždění vstupu biosimilars, potvrzuje VZP například u přípravku rituximab, kde už byly potenciální úspory ve výši více než 60 milionů zahrnuty do zdravotně pojistných plánů, ke vstupu ale nakonec došlo až nyní.
„Je to třeba ještě prodiskutovat. Už jsme v oblasti cen a úhrad léčiv spustili pracovní skupinu k revizi systému. Některé připomínky k diskuzi zaslala i Česká asociace farmaceutických firem a očekáváme, že 30procentní povinné snížení bude předmětem diskuze. Je potřeba zanalyzovat přínosy a ztráty, tedy to, o kolik jsme teoreticky přišli odkladem vstupu, a jestli by nebylo lepší snížit méně s tím, že se tím urychlí vstup a k dodatečnému snížení zřejmě stejně dojde na základě aktivní smluvní politiky zdravotních pojišťoven,“ reaguje Filip Vrubel.
K průtahům ve chvíli, kdy originálnímu léčivu skončí patent, u nás však dochází i z jiných důvodů. Příkladem za všechny budiž cytostatikum Glivec (imatinib), u něhož trvá hloubková revize na SÚKL už přes tisíc dnů. Kvůli tomu také nemohla být na žádost VZP provedena zkrácená revize, o níž pojišťovna žádala už na konci roku 2016. Podle ředitelky SÚKL Ireny Storové je společným jmenovatelem dlouho trvajících řízení to, že do spisu stále přibývají materiály.

„Je tam několik rádoby opravených podání, ale de facto jde o podání úplně nová, i když běží lhůta. Nejde tedy o to, že by žadatel jen doplnil další údaje. Dostáváme zcela přepracovaná podání, takže se hodnotitelé ocitají znovu na startu a musí materiál opět kompletně prostudovat, přičemž se bavíme o stovkách stránek poměrně vysoce odborného textu. Možná by proto stálo za to udělat přerušení. Další záležitostí jsou různá odvolání a jiné kroky, kterými se celý proces protahuje. A v neposlední řadě je to otázka personální, kdy máme jednotky farmakoekonomických odborníků, ale služební zákon nedovoluje reagovat pružně na to, že v příštím roce bude nutno udělat tolik a tolik hloubkových revizí a budou vstupovat inovativní léky, na které budeme potřebovat posuzovatele,“ vysvětluje příčiny Storová.
Zaměňování originálu a biosimilars? Na místě by bylo konsenzuální doporučení odborníků
Rezervy ale máme i v jiném ohledu. „Trochu tu chybí aktivní politika některých institucí po vzoru západních autorit, které vydávají doporučení či seznamy a snaží se potenciál biosimilars využít větším způsobem,“ myslí si Martin Mátl. „Když se podíváme na německou autoritu nebo jiné západoevropské instituce, dávají doporučení ohledně zaměňování biosimilars, čímž do jisté míry ukončují diskusi o tom, kdy a jak se k biosimilars postavit. Může to přispět k tomu, že se určitá fáze překoná rychleji a je větší potenciál k využití biosimilars,“ dodává.
Jeho slova potvrzuje také doktorka Miková z VZP. „Nyní je přístup k biosimilars na libovůli buď zdravotních pojišťoven, nebo jednotlivých pracovišť, takže využití není v reálné praxi stejné,“ přitakává. „Očekávala bych konsenzuální stanovisko stakeholderů napříč systémem, aby byl jednoznačný postup pro všechny odborníky a skupiny. Máme totiž informace, že v některých diagnostických skupinách jsou biosimilars využívány více, dokonce i v rámci switchů, zatímco jinde je to na domluvě s pacientem. Měla by tu tedy být obecná platforma, která by doporučila postup,“ dodává Alena Miková.

Nejvíce zkušeností s biosimilars má dnes revmatologie, kde už se běžně switchuje, tedy převádí se z originálu na biosimilar. Biosimilární a originální přípravky jsou tu přitom brány rovnocenně. To také kvituje náměstek Vrubel, podle kterého by tímto směrem měly jít i další odbornosti. „Rozdíly mezi jednotlivými odbornostmi dnes jsou, a někdy i propastné. Jsou profesoři, kteří vám řeknou, že biosimilars vůbec nechtějí, natožpak switche. Je tu tedy prostor na edukaci odborné veřejnosti,“ poukazuje Filip Vrubel.

„Máme ale určité výhrady ke dvěma věcem. První je multiple-switching, kdy bude mít pacient každé tři měsíce něco jiného podle toho, kdo vyhraje tendr. Tam už může být problém imunogenicita. Druhá věc je, že i v konsenzuálních doporučeních stojí, aby byl switch dělán po společném rozhodnutí lékaře s pacientem, nikoliv administrativně od pojišťovny nebo ředitele nemocnice. Velmi vážně se totiž začalo hovořit o nocebo efektu. Mám data z registru, kdy jsou pacienti po switchi velmi dobří, ale přesto vypadávají. Představte si, že sedíte v ordinaci s pacientem, kterého máte tři roky na léčbě a je v remisi, a vy mu řeknete, že mu dáte něco levnějšího. Proto se zaměřujeme na edukaci sester, aby věc uměly vysvětlovat. Nemyslím si tedy, že jsou nařízené switche vhodné,“ říká ředitel Revmatologického ústavu v Praze profesor Karel Pavelka, který ovšem sám přiznává, že vzhledem k budgetu a čekací listině dvou set lidí switche také nařizuje (o problematice jsme psali i zde).
Sdruženými nákupy se o přínosy biosimilars neochudíme, slibuje MZ
Obavy z omezení potenciálu biosimilars mají výrobci také v oblasti sdružených nákupů. „Když se podíváte na seznam potenciálních molekul, které by se mohly soutěžit, najdete mezi nimi i ty, u nichž se dá v blízké době očekávat vstup biosimilars. V okamžiku, kdy proběhnou sdružené nákupy pro významný počet nemocnic, které tvoří hlavního odběratele pro tento typ léků, a uzavře se smlouva třeba na čtyři roky těsně předtím, než biosimilars vstoupí, trh se tím zmrazí a zmenší se možnost biosimilars využít,“ obává se Martin Mátl. V letech 2018 až 2022 by přitom měly přijít biosimilars k několika důležitým molekulám – adalimumabu, pegfilgrastimu, trastuzumabu či bevacizumabu.
V tomto směru ovšem uklidňuje jak ministerstvo zdravotnictví, tak i zdravotnická zařízení. „Rozhodně nepůjde o nákupy na čtyři roky, kde bychom zbytečně přicházeli o to, že za rok dva budou ceny někde jinde. Víme, že každý rok se ceny mění,“ konstatuje náměstek Vrubel. Pokud se přitom očekává vstup biosimilars (nyní například u trastuzumabu), ani zdravotnická zařízení obvykle neplánují výběrové řízení na více než rok a půl a v případě výrazného cenového výkyvu na situaci okamžitě reagují tak, aby nenakupovaly přípravek dražší o desítky procent.

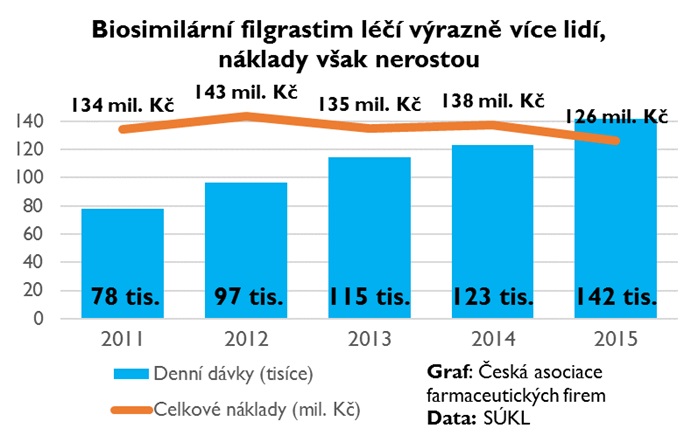
A jak na tom jsme s využitím biosimilars v Česku celkově? Před třemi lety jsme byli podle OECD v penetraci biosimilárních přípravků (epoetinu a anti-TNF) na pátém místě – u epoetinu šlo skoro o sto procent, u anti-TNF (infliximab) o 25 procent. Pokud by přitom podle čísel SÚKL od roku 2008 do 2018 neprobíhaly v souvislosti s biosimilars hloubkové revize, kterých se ovšem zatím uskutečnily pouze jednotky, byly by náklady na léčivé přípravky vyšší o 1,5 miliardy. Zkrácené revize pak od roku 2013 přinesly 50 procent úspor.
Kdybychom se podívali na lékový budget dohromady, náklady mezi lety 2011 a 2016 mírně vzrostly, ovšem jen o necelých pět procent. Výrazně se však zvýšil podíl centrových léčiv, zatímco receptové léky přinesly úspory a tento růst vyrovnaly. Co se pak týče centrových léčiv, právě díky biosimilars se daří zvyšovat proléčenost pacientů a za stejné prostředky výrazně zlepšovat dostupnost terapie.
Kulatý stůl se konal díky laskavé podpoře České asociace farmaceutických firem a Zdravotní pojišťovny Ministerstva vnitra ČR.
Michaela Koubová, foto: Martin Kovář