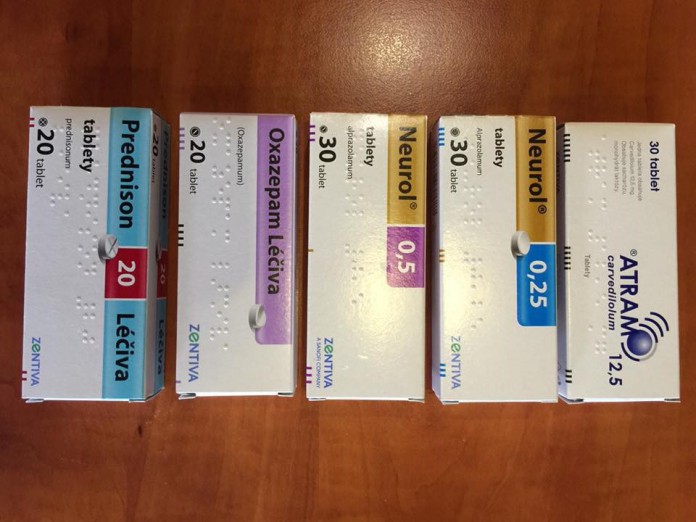
Zentiva v souvislosti s loňským případem záměny léků neporušila zákon. Nešlo o technickou chybu, ale o úmyslné selhání jednotlivce. Vyplývá to ze závěrů kontroly, kterou ve výrobním závodě Zentivy udělal Státní ústav pro kontrolu léčiv (SÚKL). Novinářům to včera řekl ředitel SÚKL Zdeněk Blahuta. Při jiné kontrole ale ústav firmě udělil pokutu 500.000 korun za to, že při vývozu léků do zahraničí nedokončila kontrolu jakosti.
Některé léky od Zentivy byly loni staženy od pacientů a ze zdravotnických zařízení kvůli podezření, že balení mohou obsahovat jiné tablety. Důvodem stahování byl podle Zentivy nález dvou blistrů (plastových lisovaných obalů) přípravku Neurol v krabičkách označených jako přípravek Atram v Polsku, které byly vyrobeny v pražském závodě Zentivy.
Ústav v souvislosti s tímto případem udělal v Zentivě kontrolu, která nezjistila žádné porušení zákona o léčivech. „Tým SÚKL zjistil, že se nejednalo o technický problém, ale o úmyslné selhání jednotlivce,“ řekl Blahuta. Společnost Zentiva kvůli tomu už na podzim podala trestní oznámení na neznámého pachatele. Zavedla také některá opatření, která by měla podobným případům do budoucna zamezit. „Zvýšili jsme počet pravidelných vnitřních inspekcí zaměřených na dodržování správných výrobních postupů,“ napsal ČTK mluvčí Zentivy Filip Hrubý.
Celkem bylo podle Blahuty staženo přes 100 milionů balení a šlo o největší takový případ v Česku. Lidé také ústavu nahlásili 105 podezření na nežádoucí účinky, které by mohly s případem souviset. Kontrola SÚKL ale žádnou záměnu nebo závadu v jakosti nepotvrdila.
Mohlo by vás zajímat
SÚKL ale loni v dubnu udělal v závodě Zentivy pravidelnou kontrolu, při které zjistil porušení zákona v souvislosti s vývozem léků do zahraničí. Spočívalo podle Blahuty v tom, že Zentiva léčivé přípravky vyvezla před dokončením kontroly jakosti a předtím, než bylo jejich vyvezení potvrzeno kvalifikovanou osobou. Za to musí firma zaplatit pokutu půl milionu korun.
Zentiva prohřešek uznává. „Na straně Zentivy skutečně došlo k pochybení, při němž však v žádném případě nehrozilo, že by na trh byl uvedený léčivý přípravek, u něhož nebyla dokončena kontrola kvality. Došlou pouze k tomu, že byl léčivý přípravek předčasně přemístěn z pražského výrobního závodu do skladu Zentivy ve Velké Británii v rozporu s registrační dokumentaci,“ uvedl Hrubý.
-čtk-