Personalizace v onkologii není jen otázkou léčby. Do budoucna by se měla týkat i primární a sekundární prevence

Díky personalizované precizní tumor agnostické onkologii můžeme v klinické praxi léčit stejnou terčovou léčbou nádory žaludku i nádory prsu, říká profesor Luboš Petruželka. Foto: Stanislav Pecháček
Na základě genomické analýzy léčit nádory bez ohledu na to, kde se v těle nacházejí – takový je trend v oblasti onkologie. Ruku v ruce s tím se začíná měnit i způsob, jak získávat data pro evidence-based medicínu – se změnou přístupu totiž přestávají být velké randomizované studie proveditelné. Personalizace by navíc do budoucna neměla být jen záležitostí léčby, ale genetické analýzy zřejmě budou využívány i v rámci primární a sekundární prevence. Na II. ročníku mezinárodního panelu konference Zdravotnického deníku Ekonomika prevence to řekl přednosta Onkologické kliniky 1. LF UK a VFN Luboš Petruželka.
Ročně u nás bývá diagnostikováno kolem 60 tisíc nádorů, přičemž mezi nejčastější patří rakovina prostaty, prsu, kolorekta či plic. 30 tisíc pacientů pak každý rok svému onkologickému onemocnění podlehne, nejčastěji kvůli rakovině plic, kolorekta a slinivky. Pokud se však podíváme na mezinárodní srovnání v čase, zlepšujeme se. Zatímco na přelomu tisíciletí jsme ve výskytu rakoviny byli na čele pomyslného žebříčku, nyní se pohybujeme okolo průměru (co se týče mortality, posunuli jsme se z 2. na 22. místo) – a také pětiletá míra přežití pacientů s rakovinou se v ČR přiblížila průměru EU. Jedním z důvodů je zřejmě primární a sekundární prevence.
“Ke snížení zátěže je nejúčinnější cestou primární prevence. Rakovina patří stejně jako kardiovaskulární onemocnění mezi civilizační choroby a i rizikové faktory se prolínají,” přibližuje Luboš Petruželka.
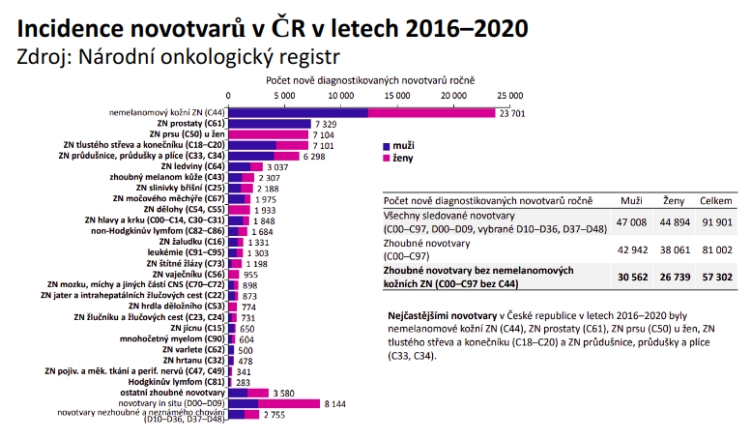
Faktem tak je, že čtyřem z deseti nádorů by bylo možné zabránit, protože vznikly vlivem preventabilních faktorů. Tím, který má největší vliv, je kouření, dále obezita, alkohol, UV záření, špatná výživa, infekce a fyzická (ne)aktivita. Co se přitom týče kouření, jeho omezení se už u nás projevilo nižší mortalitou na karcinom plic. Přesto by podle profesora Petruželky bylo na místě dále posouvat a personalizovat screeningové programy.
Klinické studie se budou měnit
Další posun by měla přinést precizní a personalizovaná onkologie, při které bude léčba individualizována pro každého nemocného a každý nádor. Na základě molekulární genomické charakteristiky totiž lze charakterizovat každý nádor a podle toho zvolit léčbu, která se navíc přizpůsobí charakteristice nemocného. Dnes je už možné identifikovat skupiny, pro které bude léčba přínosem, a zároveň tak lze vyloučit ty, u nichž by nezabrala.
“Ukazuje se, že stejný přístup k nemocným ve stejném klinickém stadiu a se stejným morfologickým nádorem musí být ukončen. Histologie už není dostačující pro výběr léčby, dostáváme se k anatomii molekulární. Urgentně ale potřebujeme optimalizaci genomického testování a je třeba v širších aspektech zavést sekvenování nové generace, které nahradí dřívější sekvenování jednoho genu jednou metodou. Multiplexní testování totiž je a bude výrazně levnější než individuální testování,” vysvětluje Luboš Petruželka s tím, že v Česku máme úhradu genomického testování u karcinomu prsu, plic, kolorekta a nádorů primárního neznámého zdroje. “Jsme na tom tedy velice dobře,” dodává Petruželka.

Medicína založená na důkazech v onkologii přitom dnes vychází z nejlepší dostupné evidence, je podpořená klinickou expertízou, využívá genomických knihoven a zahrnuje hodnocení a preference pacientů. Co se ovšem týče vývoje, je zde trend jiný než například v kardiologii, kde jsou zlatým standardem randomizované studie. V onkologii takovýchto studií v posledních letech ubývá. Důvodem jsou nové klinicko-patologické jednotky, které v podstatě znemožňují udělat studie tohoto typu. Výsledkem je nutná změna organizace nebo managementu klinických studií.
Personalizace by ale neměla být jen otázkou léčby, ale do budoucna by se měla týkat i primární a sekundární prevence. Na základě genetické analýzy a environmentálních faktorů by tak měly být ušity na míru preventivní programy.
Mohlo by vás zajímat
“Je to úkol pro skupinu odborníků, kteří se zabývají preventivní medicínou. V České republice je totiž preventivní a terapeutická onkologie víceméně oddělená, protože centra zabývající se terapií nemají takový prostor na prevenci. To je ale možné zlepšit,” konstatuje Luboš Petruželka.
Návrat k pacientovi
Personalizovaná precizní tumor agnostická onkologie by zároveň neměla znamenat pouze volbu správného léku ve správné dávce pro správného pacienta ve správnou dobu, ale též inovativní použití nových léků v inovativní indikaci. Cílem je léčit každý nádor unikátně, což je však přístup, který zatím nepřekročil hranice klinického výzkumu. Nejbližší krok tak bude spočívat v selekci unikátních klinicko-molekulárně patologických podskupin nádorů v kontextu molekulárních aberací, prognózy a odpovědi na léčbu, u nichž je předpoklad nejvyšší pravděpodobnosti léčebné odpovědi na unikátní léčbu bez ohledu na primární lokalizaci a klinické stadium onemocnění.

“Je třeba vybudovat molekulární tumor boardy, což jsou skupiny odborníků, kteří budou pomáhat aplikovat precizní medicínu. Precizní medicína je přitom přístup k pacientovi, který umožňuje lékaři vybrat léčbu, která na základě genetických znaků pacientovy nemoci pravděpodobně bude nejvíce účinná. Pacienti s nádory, které mají stejné genomické změny, tak dostanou stejné léky cílené na danou změnu, a to nezávisle na typu nádoru. To je v onkologii průlom, takže v klinické praxi můžeme léčit stejnou terčovou léčbou nádory žaludku i nádory prsu,” vysvětluje profesor Petruželka. Personalizovaná precizní medicína by tak měla mimo jiné přinést konec aplikací neúčinné léčby, což s sebou ponese i menší množství komplikací.
Exponenciální nárůst dat získaných výsledků na základě genetických vyšetření a biomarkerů však znamená zvýšenou zátěž lékařů při vyhodnocení, takže je urgentně potřeba využít nové technologie k interpretaci výsledků. To s sebou nese sběr dat do genomických knihoven, zapojení umělé inteligence do vyhodnocení výsledků a vytvoření molekulárních mezioborových skupin, které budou rozhodovat. Díky zjednodušení interpretace výsledků pak dojde ke zmírnění intelektuálního přetížení lékařů při genomickém hodnocení, a tím pádem se budou moci více věnovat pacientům.
Michaela Koubová
Vydavatelství Zdravotnického deníku děkuje za podporu Mezinárodního panelu generálním partnerům konference Všeobecné zdravotní pojišťovně, společnostem OR CZ, CCA Group a MyCom a partnerům Zdravotní pojišťovně ministerstva vnitra a Vojenské zdravotní pojišťovně.







